ISO 10993-4:2017 血液相容性測試標準解讀
 2020年06月08日 |
2020年06月08日 | 閱讀次數:1094
閱讀次數:1094ISO 10993-4:2017 血液相容性測試標準解讀
凡是與人體循環血有直接或間接接觸的醫療器械,如果沒有足夠的數據證明其滿足血液相容性要求,那么都要開展血液相容性測試。其中,ISO 10993-4:2017是醫療器械血液相容性測試的重要參考標準,今天科標醫學就和大家一起解讀該標準要求,了解測試的來龍去脈。
血液相容性測試,主要用來評估與血液接觸的醫療器械、或用于血液或血液制品材料的影響。在選擇和制訂測試方案時,要將產品設計、臨床使用、使用環境和風險收益等因素納入考慮。
作為血液相容性測試的重要參考標準,ISO 10993-4:2017主要包含三塊內容:1)與血液接觸醫療器械的分類情況;2)評估血液反應的基本特性;3)測試方法的選擇。
1. 非血液接觸器械
Non-blood-contact devices(非血液接觸器械),并不是不和血液接觸的器械,而是指代,不與留在或重新輸回體內的血液或血液成分有直接或間接接觸的器械,例如,體外診斷試劑和血液采集管。
2. 外部連通器械
External communicating devices(外部連通器械)通常會和循環血接觸,并且會接入人體血管系統。那么,具體會包含哪些產品呢?下表整理了常見的三類外部連通器械,并列舉了相關實例供大家理解。
編號 | 類別 | 常見器械 |
1 | 間接血路 | 血液收集裝置、插管、細胞收集裝置、血液和血液產品的儲存和輸送裝置(如血袋和輸血管)、延伸裝置(與靜脈輸液配套使用)、血管內醫用導管 |
2 | 直接接觸循環血 | 粥樣斑塊切除裝置、直接或間接血液接觸的血液監測裝置、心肺旁路電路、吸附血液中特定物質的裝置、治療性血液分離設備、體外膜式氧合器、血液透析/血液過濾裝置、心臟和血管介入裝置、血管內導管(如配合使用氣囊、成像、激光、超聲)、白細胞去除過濾器、經皮循環支持裝置、逆行冠狀動脈灌注導管、血管導絲 |
3 | 植入器械 | 瓣膜成形環、動靜脈分流器、血液監測儀(植入式)、循環支持裝置(如心室輔助裝置、人造心臟、主動脈內球囊泵)、栓塞裝置、血管內合成血管移植物、植入式除顫器和復律器導管、下腔靜脈過濾器、體內給藥導管、血管內氧合器(如人工肺)、機械或組織心臟瓣膜、心臟起搏器導管、手術合成或組織血管移植物、血管支架 |
在明確器械種類后,就要了解產品的血液反應特性,其核心目的是為了選擇合適的測試方法。在本章內容中,有兩個關鍵點,大家需要特別注意:1)首先,本標準提供了決策流程圖,能夠幫大家理清是否需要開展血液相容性測試;2)同時,本標準列舉了與循環血接觸的器械實例,以及對應的測試類別。
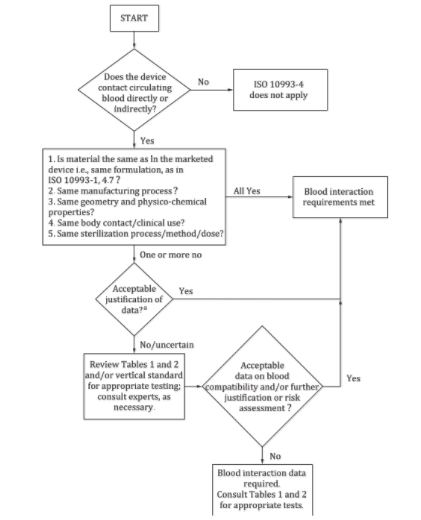
決策流程圖
通過回答下面四個問題,大家可以初步判斷自己的產品是否需要開展血液相容性測試。1)問題一:器械是否直接或間接接觸循環血?如果不是,則本標準不適用;如果是,則回答問題二;2)問題二:器械用到的材料是否和上市產品的材料一致?是否經歷相同的加工過程?是否具備同樣的結構和理化性質?是否與人體接觸?是否具備同樣的臨床使用方法?是否經歷滅菌過程,用到的方法和劑量是否相同?如果全是,則滿足血液反應要求,無需開展測試;如果有一條及以上不符合,則回答問題三;3)問題三:對于差異部分進行評估,判斷數據是否可接受?如果是,則無需開展測試;如果不是或不確定,則繼續評估表格1和2內容,或參考相關垂直標準,或咨詢專業人士,進而回答問題四;4)問題四:進一步判斷或評估風險,血液相容性數據是否可接受?如果是,則無需開展測試;如果不是,則要按照表格1和2,開展血液相容性測試。
常見器械及對應測試類別
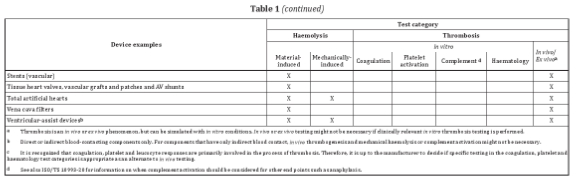
針對外部連通器械和植入器械,表格1列舉了與循環血接觸的常見器械或器械組分,并提供了可參考的測試類別。例如血液監測裝置,可考慮的測試包括:材料介導的紅血球溶解實驗,體外凝血、血小板激活及血液學實驗。

如果明確了測試類別后,接下來,廠商要考慮的就是產品的血液反應特性。具體而言,與之相關的參數包括:產品的結構形狀、材料理化性質、表面特性和滅菌條件,產品接觸時長和環境溫度,以及抗凝和血液流動條件等。如果要進行動物研究,例如植入產品,則要盡可能貼近臨床使用情況。當然,這么多參數不一定都要納入考慮范圍,廠商要根據產品特性,特別是要基于已有的研究或文獻資料,選擇重藥關注的特性參數。
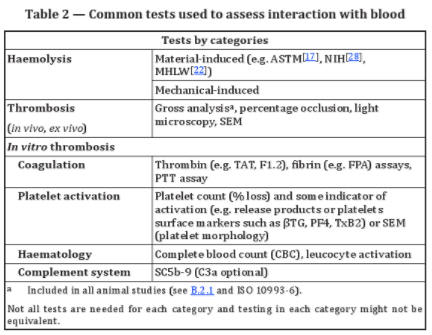
一般而言,標準推薦的血液相容性測試可以分為兩大類:1)溶血試驗:包括材料介導和機械介導;2)血栓試驗:體外實驗包括凝血、血小板激活、補體激活和血液學試驗,另外還包括直接體內實驗(In vivo tests)和間接體內實驗(Ex vivo tests)。詳見表格2。
具體來說:
如果開展體外試驗(in vitro tests),通常要考慮的試驗變量有:血細胞比容、抗凝血劑(類型和用量)、血液/血液成分年齡、樣品制備、樣品表面積與血容量的比值、樣品儲存、溫度、pH、流體流動條件(如流速、貼壁剪切力和速率)等。
另外,如果器械的預期用途是離體使用,如血液透析裝置,那么離體試驗(ex vivo tests)就必不可少了。通過離體測試系統,可以監測血小板粘附、血栓形成、纖維蛋白原沉積、白細胞粘附、血小板活化等現象。其中,血流速率可以由多普勒或電磁流量探頭實時測量,流速的改變可以顯示血栓沉積和栓塞形成。
如果是涉及植入器械(比如血管支架和心臟瓣膜)的體內動物試驗,要盡可能貼近臨床使用情況。通常,會將“導管或裝置的通暢度(即通過裝置的非閉塞血流)”作為體內試驗的重要評價指標。此外,在移除裝置后,也會對植入器械周圍組織和器官病理學進行評估。當然,廠商可以根據產品特點和實際需求,使用額外的評估方法,比如血管造影、血管內超聲(IVUS)等技術。
ISO 10993-4:2017通讀下來,對于與血液接觸的醫療器械分類情況、血液反應的基本特性以及常用測試方法,做了簡單介紹。但關于試驗方案設計以及具體的測試要求,例如如何開展體內血栓、體外溶血、血小板激活等試驗,本文并未做詳細說明,若有需要的話,大家可以參考附錄A-G。
參考資料:
[1] ISO 10993-4:2017 Biological evaluation of medical devices -- Part 4: Selection of tests for interactions with blood








